Batteridriftsprincip
Hur fungerar en väggklocka, en TV-fjärrkontroll eller en radiostyrd barnleksak? De flesta kommer utan att tveka svara "från batterier" och i princip kommer de att ha rätt. Men det är osannolikt att någon av dem kommer att kunna berätta exakt hur det bärbara batteriet tredubblas, hur det fungerar och utan vilket hela processen att överföra elektrisk ström från batteriet till slutkonsumenten skulle vara omöjlig. Låt oss fylla denna irriterande kunskapslucka.
Innehållet i artikeln
Batteridriftsprincip
För att förstå principen för driften av ett konventionellt AA-batteri måste du ha en allmän förståelse för dess struktur. Så, vilket batteri som helst består av tre huvudelement - anod, katod och elektrolyt. Dessutom kan den senare ha praktiskt taget vilket tillstånd av aggregering som helst: katoden och anoden placerade i en saltlösning är i princip också ett "batteri", bara i en form som är ovanlig för den genomsnittliga personen.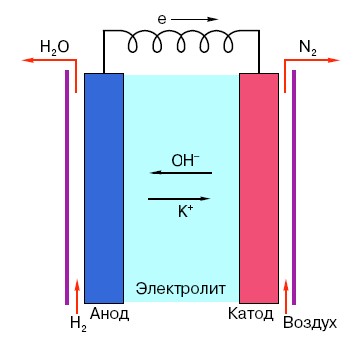
Intressant! Den så kallade "voltaiska kolonnen", uppfunnen av Alessandro Volta, hade också alla element som behövs för produktion av elektrisk ström. Den bestod av zink- och kopparplattor staplade på varandra, mellan vilka en trasa indränkt i syra lades som ett "lager".
Anoden i sådana system är den huvudsakliga källan till elektroner, som, som vi vet från en skolfysikkurs, har en negativ laddning.Negativt laddade partiklar attraheras av positiva, och i detta fall fungerar katodytan som ett "plus".
Men detta räcker inte för att en elektrisk ström ska uppstå, eftersom elektroner också behöver en slags "motorväg" - ett medium som skulle stödja interaktionen mellan katoden och anoden. Det är här som en elektrolyt dyker upp "på scenen" - ett salt, alkali eller syra som kan leda ström.
Låt oss titta på funktionsprincipen med hjälp av ett specifikt exempel: det finns ett batteri som är klassat till 18 volt. Spänningen mellan elektroderna i den är stabil tills den är ansluten till nätverket. Så snart en konsument dyker upp (till exempel en vanlig glödlampa), börjar spänningen gradvis minska, ström börjar flyta från den "negativa" elektroden till den "positiva" och en kemisk reaktion sker i elektrolyten som syftar till att upprätthålla potentialskillnaden mellan elektroderna.
Referens. Ju mer energi konsumenten kräver, desto intensivare blir reaktionen inuti batteriet och desto snabbare kommer den att misslyckas.
Hur ett uppladdningsbart batteri fungerar, hur det skiljer sig från ett vanligt
Så vi har tittat på de klassiska "finger"- och "lillfinger"-batterierna och vi vet att livslängden för de flesta av dem är strikt begränsad (oavsett vad kända tillverkare säger). Men hur är det med de så kallade batterierna - batterier av batterityp som inte bara kan förbruka energi under reaktionsprocessen, utan också ackumulera den och lagra den under lång tid?
För att förstå principen för batteriets drift är det nödvändigt att vända sig till kemi. Låt oss ta som exempel... En vanlig koleld.Oavsett hur vacker och fascinerande lågan ser ut, vet alla kemister som observerar den att denna process bara är en långvarig reaktion av bränsleoxidation. Förbränning av kol interagerar med syre och som ett resultat av denna reaktion får vi:
- koldioxid;
- ljus;
- värma.
Och om de två sista punkterna är kapabla att värma själen och kroppen, så kan vi inte använda koldioxid på något sätt, eftersom det är en biprodukt av reaktionen, som i själva verket är dess avfall. Oxidationsreaktionen upphör när startelementen: syre och kol tar slut. Att stoppa reaktionen i ett batteri sker på exakt samma sätt när utgångsämnena är helt slut och bara "avfall" återstår.
I batteriet händer allt lite annorlunda. Faktum är att reaktionen som inträffar i den tillhör kategorin reversibel, det vill säga under vissa förhållanden kan den "vändas" och återföra alla ämnen till sitt ursprungliga tillstånd. Det är möjligheten att en reversibel reaktion inträffar i batteriet som gör att det kan laddas.
I ett batteri anslutet till nätverket fortsätter reaktionen i motsatt riktning, och strömmen flyter från "plus" till "minus" och inte vice versa. Som ett resultat bildar reaktionsprodukten utgångsämnena och ägaren av batteriet får tillgänglig "återvunnen" energi i ett bärbart format. Det är allt!





